- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
外泌体的提取方法:1.超速离心法(差速离心)。超离法是较常用的外泌体纯化手段,采用低速离心、高速离心交替进行,可分离到大小相近的囊泡颗粒。超离法因操作简单,获得的囊泡数量较多而广受欢迎,但过程比较费时,且回收率不稳定(可能与转子类型有关),纯度也受到质疑;此外,重复离心操作还有可能对囊泡造成损害,从而降低其质量。2.密度梯度离心。在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,是一种区带分离法。通过密度梯度离心,样品中的外泌体将在1.13-1.19g/ml的密度范围富集。此法获得的外泌体纯度较高,但步骤繁琐,耗时,对离心时间极为敏感。外泌体提纯试剂盒的特色与优势:纯化和富集的完整血浆/血清,尿液和细胞培养基中外泌体可用于功能研究。长沙正规外泌体提取试剂厂家推荐
研究初次发现疟原虫传染小鼠血浆外泌体(exosomes)能够压制一些病症血管生成,并初步阐明其分子机制。研究加深了对疟原虫传染宿主所分泌的外泌体与一些病症血管生成之间的相互作用的认识,为开发疟原虫传染来源的外泌体作为一种新型抗一些病症制剂奠定了基础。研究人员选用肺病小鼠模型作为研究对象,从传染疟原虫的小鼠血浆中获得外泌体,并将这些外泌体注射到小鼠的一些病症内部,并与没有疟原虫传染的小鼠血浆外泌体进行对照。研究发现,疟原虫传染小鼠的血浆外泌体明显压制一些病症血管的生成。进一步的研究发现,疟原虫传染的小鼠血浆外泌体通过至少四种特殊的微小RNA(miR16-5p/17-5p/322-5p/497-5p)压制血管内皮细胞VEGF受体(VEGFR2)的表达从而阻断血管生成的信号通路。这些发现加深了人们对疟原虫抗病机理的理解,并为疟原虫疗法治病一些疾病的临床研究提供进一步的理论依据。长沙正规外泌体提取试剂厂家推荐外泌体提取:样品中大分子不能进入凝胶孔,只能沿多孔凝胶粒子之间的空隙通过色谱柱,被流动相洗脱出来。
PS不是你想有,想有就能有,迄今为止所发现的外泌体,并非所有的外膜表面都暴露PS。例如,细菌来源的外泌体膜表面没有PS,因此,本款试剂不能提取这种外泌体。现在的研究尚未得知是否所有的外泌体上都会露出PS,但是上述的外泌体标记根据细胞种类不同表现出的信号强弱差大,通过利用本试剂盒PS亲和法捕捉、提取外泌体是较好的方法。:这个MagCapture™ExosomeIsolationKitPS,1次提取的外泌体量大概是多少?实验样品的种类和体积不同,提取的外泌体量也不一样。Wako的操作实例中,一次提取操作可获得蛋白量约30μg/mL(BCA法检测),粒子数1~2×1010(NanoSightLM10检测)(经莫能菌素钠刺激外泌体分泌的K562培养上清5mL浓缩为1mL后,对其进行提取)。另外,和光验证了从1mL正常人混合血清提取一次,可回收约34μg/mL蛋白质(BCA法检测),约5×109/mL的粒子数(NanoSightLM10检测)。本试剂盒终可获得100μL的洗脱液。
外泌体与肺病预后:外泌体mirRNA和蛋白质被认为是NSCLC的预后因子。Dejima等在研究NSCLC患者预后的生物标志物时发现,外泌体miR-4257和miR-21的含量显着上升。此外,还有研究表明,低水平miR-146a-5p的NSCLC患者较高水平miR-146a-5p的NSCLC患者有更高的复发率。Sandfeld-Paulsen等在研究276例NSCLC患者血浆的外泌体时发现,NY-ESO-1是其中对低生存率有显着影响的标志物。Silva等利用TaqMan低密度芯片的方法系统分析了28位NSCLC患者体内的365种miRNA,其中let-7f、miR-30e-3p和miR-20b表达均下调,进一步研究发现,let-7f和miR-30e-3p水平可以区分早期和晚期NSCLC患者,高水平let-7f和miR-30e-3p与不良预后密切相关。如何高效地提取外泌体是实现这项新兴液体活检技术临床常规化应用的关键。外泌体提取:重复离心操作还有可能对囊泡造成损害,从而降低其质量。

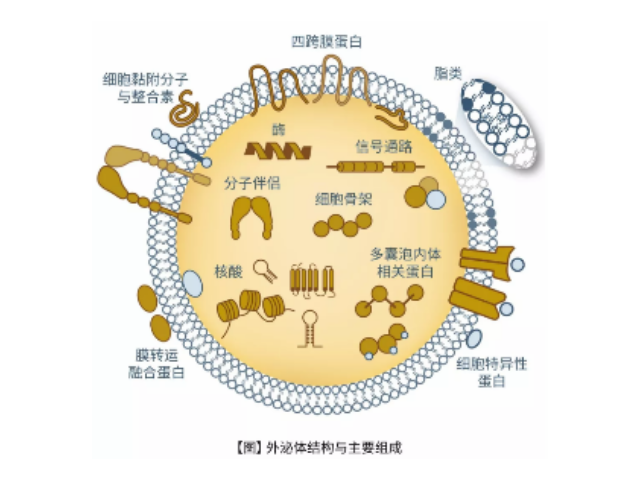
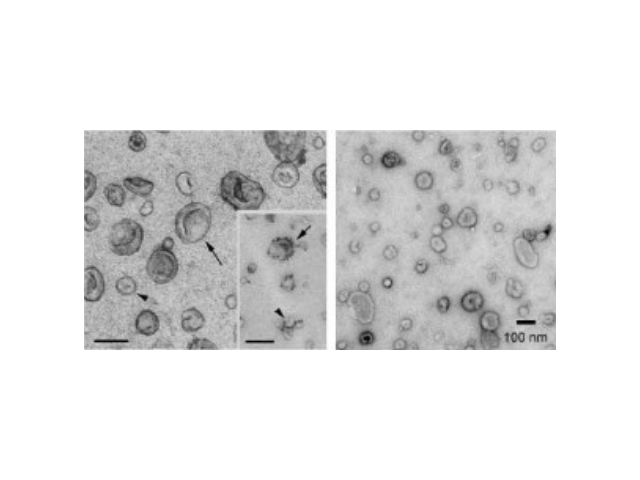
脑组织分离方法简述:将脑组织剪成薄片,放入离心管中加上消化液进行消化,经水浴、反复轻轻上下颠倒,再用移液间断缓慢吹吸至消化结束。随后加入培养基于消化液中,混匀,置于冰上。再进行一系列的差速超速离心过程,包括除杂、滤膜过滤、超离等。较后用PBS重悬外泌体,用重悬后的外泌体进行下面的透射电镜(TEM)、纳米粒径追踪分子(NTA)和markerWB鉴定。外泌体(Exosomes)是细胞分泌到胞外的一种囊泡(ExtracellularVesicles,EVs),其大小为30-150nm,具有双层膜结构和茶托状形态,含有丰富的内含物(包括核酸、蛋白和脂质等),参与细胞间的分子传递。外泌体普遍存在于细胞培养上清以及各种体液中,包括血液、唾液、尿液、、乳汁等,同时也存在于组织样本中,如脑组织、肌肉组织、脂肪组织等。外泌体提取:免疫分离外泌体的原理大多是通过抗体包被的微球,特异性结合外泌体。长沙正规外泌体提取试剂厂家推荐
外泌体的提取、分离方法:聚合物沉淀法。长沙正规外泌体提取试剂厂家推荐
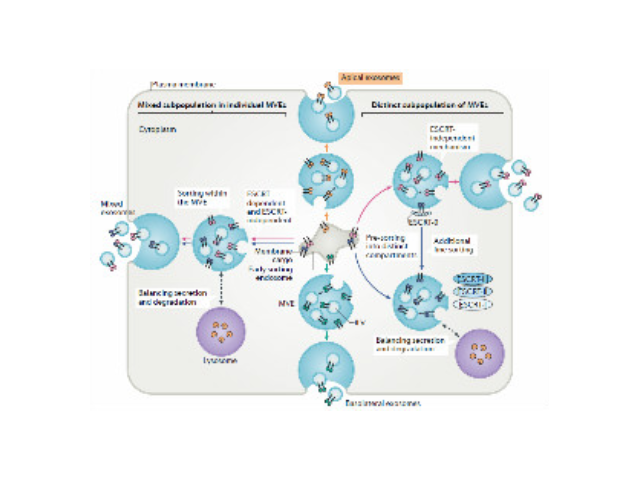
人体几乎所有类型的细胞都能分泌外泌体,外泌体普遍存在并分布于各种体液中,携带多种蛋白质、mRNA、miRNA和脂质类物质等,作为重要的传递信号分子,形成了一种全新的细胞-细胞间信息传递系统,可参与细胞通讯、细胞迁移、血管新生和一些病症细胞生长等过程。外泌体与微泡:我们知道,细胞间相互作用可以通过释放蛋白质、核酸、脂质等分子到胞外与受体结合从而介导胞内细胞传导。除此之外,细胞还可以释放膜囊泡,外泌体与微泡就是其中两种,二者相似但形成方式不同:外泌体是细胞内内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中的膜囊泡,而微泡则是细胞出芽与细胞膜融合后直接脱落形成的囊泡,且外泌体大小均一,直径在40~100nm,其大小取决于其起源部位以及细胞中的脂质双层结构;而微泡大小不一,直径在50~1000nm之间。唐山正规外泌体提取试剂产品介绍在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,是一种区带分离法。长沙正规外泌体提取试剂厂家推荐
外泌体的生物学功能研究中需要分离完整的外泌体颗粒,而传统超速离心方法步骤繁琐、硬件要求高、操作难度大。李记生物自主开发的外泌体快速提取试剂盒,组分经过优化处理,适用于细胞培养上清液、血清、血浆、尿液及其他体液(脑脊液、腹水、羊水、乳汁以及唾液等)中的外泌体提取,并搭配纯化过滤装置,可快速高效地获得高纯度外泌体颗粒。注意事项:1.对于待测样品粘度过大时,可将样本用4℃预冷的1×PBS缓冲液进行等体积稀释处理。2.当血清、血浆、唾液等样品收获的外泌体浓度较高,收获的外泌体颗粒无法通过EPF柱纯化时,可用4℃预冷的1×PBS进行稀释后再通过EPF柱离心。用无菌针管吸取上层含有外泌体的液体,置于80℃...
- 金华外泌体提取试剂哪家便宜 2025-07-04
- 济南正规外泌体提取试剂哪里买 2025-07-04
- 金华外泌体提取试剂推荐厂家 2025-07-04
- 无锡外泌体提取试剂哪里买 2025-07-04
- 金华正规外泌体提取试剂平均价格 2025-07-04
- 昆明正规外泌体提取试剂哪家便宜 2025-07-04
- 郑州外泌体提取试剂供应商 2025-07-04
- 济南外泌体提取试剂哪里买 2025-07-04
- 深圳外泌体提取试剂销售厂家 2025-07-04
- 济南外泌体提取试剂直销价 2025-07-04
- 天津正规外泌体提取试剂报价 2025-07-04
- 芜湖外泌体提取试剂厂家批发价 2025-07-04
- 昆明外泌体提取试剂服务电话 2025-07-04
- 广州正规外泌体提取试剂哪家好 2025-07-04
- 广州正规外泌体提取试剂厂家批发价 2025-07-04
- 广州正规外泌体提取试剂平均价格 2025-07-04


- 合肥正规细胞外基质胶推荐厂家 07-05
- 金华外泌体提取试剂哪家便宜 07-04
- 天津正规细胞外基质胶哪里买 07-04
- 济南正规外泌体提取试剂哪里买 07-04
- 金华外泌体提取试剂推荐厂家 07-04
- 无锡外泌体提取试剂哪里买 07-04
- 苏州细胞外基质胶直销价 07-04
- 金华正规外泌体提取试剂平均价格 07-04
- 昆明正规外泌体提取试剂哪家便宜 07-04
- 郑州外泌体提取试剂供应商 07-04